Desde épocas remotas, los humanos se han interesado por la naturaleza de la materia. Las ideas modernas sobre la estructura de la materia se basan en la teoría atómica de Dalton de principios del siglo XIX. En la actualidad se sabe que toda la materia esta formada por átomos, moléculas y iones. La química siempre se relación de una u otra manera con estas especies.
Respecto al estudio de la estructura interna de la materia, a través de la historia se plantearon muchos pensamientos filosóficos y teorías científicas para poder explicar las propiedades del mundo material que nos rodea, en la antigüedad había dos grandes corrientes: los atomistas y los continuistas.
Teoría atómica de Leucipo y Demócrito
El atomismo es un sistema filosófico que surgió en la antigua Grecia durante el siglo V a. C. Sus seguidores, los atomistas decían que la materia es discontinua, es decir, establecieron que el universo está constituido por combinaciones de pequeñas partículas indivisibles denominadas átomos, término que en griego significa (a = sin, tomo = parte), es decir, que no se puede dividir, y que todo está hecho de estas partículas. De este modo, en el año 400 a.C. Demócrito de Abdera, filósofo griego pre-socrático y matemático discípulo y después sucesor de su maestro Leucipo de Mileto propusieron la primera teoría atómica llamada:
“Discontinuidad de la Materia”
A ellos dos se les atribuye la fundación del atomismo mecanicista, Demócrito, fue el primer hombre que pensó en el átomo, decían que la materia se podía dividir indeterminadamente en partículas cada vez más pequeñas hasta obtener piezas muy diminutas e indivisibles. De este modo, conjeturó que la materia debía estar formada por partículas muy pequeñas, indivisibles, invisibles y que consideró indestructibles. De igual manera, supuso que los átomos de cada elemento eran diferentes en tamaño y forma y que esas diferencias eran las que hacían que cada elemento tuviera diferentes propiedades.
Demócrito y su maestro Leucipo concluyeron que:
- Los átomos son eternos, indivisibles, homogéneos, incomprensibles e invisibles.
- Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas.
- Las propiedades de la materia varían según el agrupamiento de los átomos.
- Todo está hecho de átomos, si dividimos una sustancia muchas veces, llegaremos a ellos.
Esta manera de pensar por parte de Demócrito y su mentor, que ahora parece de gran actualidad, no logró trascender mucho en su época, en realidad esta teoría no fue de gran aceptación entre muchos filósofos clásicos griegos de la época, entre ellos tenemos a Empédocles de Agrigento y su alumno Aristóteles, que consideraban absurda esta teoría atómica y la rechazaban, por otra parte, estos proponían una nueva teoría.
Los continuistas pensaban que los átomos no existían, si los átomos no pueden verse, entonces no existen, Empédocles quien postuló la teoría de las cuatro raíces, y su discípulo Aristóteles después llamó elementos, rechazan la idea del atomismo.
Según la doctrina aristotélica no puede existir el vacío subyacente entre las partículas, esta era constituida de forma continua, es decir, que no puede dividirse en partes irreductible, así fue como el atomismo perdió seguidores, fue olvidado y se desechó el atomismo.
Los continuistas pensaban que:
- Los átomos no existen.
- No hay límite para dividir la materia
- Si las partículas llamadas átomos no pueden verse entonces es que no existen.
- Todas las sustancias están formadas por las combinaciones de los 4 elementos básicos: Agua-Aire-Tierra-Fuego
TEORÍA O MODELO ATÓMICO DE JOHN DALTON
Se conoce como la Teoría atómica de Dalton o el Modelo atómico de Dalton al primer modelo de bases científicas respecto a la estructura fundamental de la materia. Fue postulado entre 1803 y 1807 por el naturalista, químico y matemático británico John Dalton (1766-1844), bajo el nombre de “Teoría atómica” o “Postulados atómicos”.
Este modelo propuso una explicación científicamente verosímil a la mayoría de los enigmas de la química del siglo XVIII y XIX. Postula que toda la materia del mundo está compuesta por átomos, es decir que existe un número finito de partículas fundamentales.
Además, sostiene que simplemente a partir de la combinación de estas partículas, son posibles todas las estructuras complejas de la materia. El antecesor directo fueron los griegos de la antigüedad clásica
Los postulados de este modelo son:
- La materia se constituye de partículas mínimas, indestructibles e indivisibles llamadas átomos.
- Los átomos de un mismo elemento son siempre idénticos entre sí, con la misma masa y las mismas propiedades. En cambio, los átomos de elementos diferentes tienen masas y propiedades distintas.
- Los átomos no se dividen, ni pueden crearse ni destruirse durante las reacciones químicas.
- Los átomos de elementos distintos pueden juntarse para formar compuestos en diferentes proporciones y cantidades.
- Cuando se combinan para formar compuestos, los átomos se ordenan según relaciones simples, describibles mediante números enteros.
Con base en la teoría atómica de Dalton, un átomo se define como la unidad fundamental y básica de un elemento que puede intervenir en una combinación química. Sin embargo, una serie de investigaciones iniciadas alrededor de 1850, y que continuaron hasta el siglo XX, demostraron claramente que los átomos tienen una estructura interna, es decir, que están formados por partículas aun mas pequeñas, denominadas partículas subatómicas. Estas investigaciones fueron avances muy importantes para el descubrimiento de tres partículas: el electrón, el protón y el neutrón.
DESCUBRIMIENTO DEL ELECTRÓN
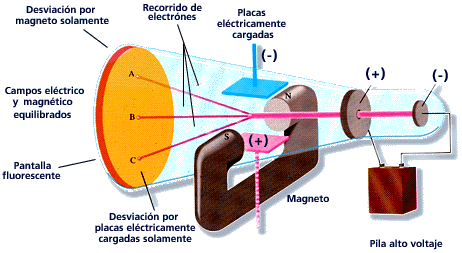
El primer tubo de rayos catódicos fue construido por Michael Faraday (1791-1867) hace 150 años aproximadamente. Al hacer pasar la electricidad a través de tubos de vidrio sometidos al vado, Faraday descubrió los rayos catódicos, un tipo de radiación emitida por el polo negativo o cátodo. La radiación atravesaba el tubo evacuado hada el polo positivo o ánodo. Posteriormente los científicos encontraron que los rayos catódicos viajan en línea recta y tienen propiedades que son independientes del material del cátodo (es decir, de si éste es hierro, platino, etc.).
Otra observación importante sobre los rayos catódicos es que son desviados por los campos eléctricos y magnéticos de la forma esperada para las partículas cargadas negativamente.
En 1897, J.J. Thomson (1856-1940) estableció la relación entre la masa (m) y la carga eléctrica (e) de los rayos catódicos, es decir, m/e. Thomson, también concluyó que los rayos catódicos son partículas fundamentales de materia cargadas negativamente y que se encuentran en todos los átomos. (Las propiedades de los rayos catódicos son independientes de la composición del cátodo). Posteriormente, a los rayos catódicos se les dio el nombre de electrones, término propuesto por George Stoney en 1874.
MODELO ATÓMICO DE THOMPSON
Una vez considerado el electrón como una partícula fundamental de la materia existente en todos los átomos, los físicos atómicos empezaron a especular sobre cómo estaban incorporadas estas partículas dentro de los átomos. El modelo comúnmente aceptado era el propuesto por J.J. Thompson en 1904. Thomson pensó que la carga positiva necesaria para contrarrestar las cargas negativas de los electrones en un átomo neutro estaba en forma de una nube difusa. Sugirió que los electrones, flotaban en esta nube difusa de carga positiva, semejante a una masa de gelatina con los electrones a modo de «frutas» embebidos en ella. A este modelo se le dio el nombre de budín de ciruelas por su semejanza con un conocido postre inglés (ciruelas en ingles del siglo XIX es un uso arcaico referido a pasas).
Robert Millikan, (1868-1953), determinó la carga electrónica “e” mediante una serie de experimentos con gotas de aceite (1906-1914). El valor de la carga electrónica aceptado actualmente, “e”, expresado en culombios con cinco cifras significativas es -1,6022 x 10-19 C. Utilizando este valor y un valor exacto de la relación masa-carga para un electrón, se obtiene que la masa de un electrón es 9,1094 x 10-28 g.
LOS RAYOS X Y LA RADIACTIVIDAD
En 1895, Wilhelm Röntgen (1845-1923) observó que cuando los tubos de rayos catódicos estaban funcionando, algunos materiales fuera de los tubos, emitían luz o fluorescencia. Demostró que esta fluorescencia era producida por la radiación emitida por los tubos de rayos catódicos. Debido que estos rayos no eran desviados de su trayectoria por un imán, no estaban constituidos por partículas con carga y a la naturaleza desconocida de esta radiación, Roentgen acuñó el término rayos X. Ahora identificamos los rayos X como una radiación electromagnética de alta energía.
Martin Heinrich Klaproth (1743-1817), científico alemán, y Jöns Jacob Berzelius (1779-1848), químico sueco. El primero descubrió a fines del siglo XVIII (1789) el elemento Uranio, y el segundo fue el descubridor del elemento Torio, a principios del siglo XIX (1828).
Antoine Henri Becquerel, cientifico frances, en 1896 descubrió una nueva propiedad de la materia que posteriormente se denominó radiactividad natural. Este fenómeno se produjo durante su investigación sobre la fluorescencia. Al colocar sales de uranio sobre una placa fotográfica en una zona oscura, comprobó que dicha placa se ennegrecía. Las sales de uranio emitían una radiación capaz de atravesar papeles negros y otras sustancias opacas a la luz ordinaria. Estos rayos se denominaron en un principio rayos Becquerel en honor a su descubridor. Sus investigaciones y descubrimientos sirvieron de base a los primeros modelos atómicos.
En 1900 halló que la radiación beta está integrada por electrones y en 1901 que el radio se podía utilizar para destruir tumores, origen de la radioterapia. En 1903, «en reconocimiento de sus extraordinarios servicios por el descubrimiento de la radiactividad espontánea» compartió con el matrimonio Curie el premio Nobel de Física.
Pierre (1859-1906) y Marie Curie(1867-1934)
Marie Curie fue discípula de Becquerel y se caso con Pierre en 1895. Marie es la primera en utilizar el termino “Radiactividad”. Juntos descubren el Radio y el Polonio y fueron premiado con el premio nobel junto a Becquerel el año 1903.
DESCUBRIMIENTO DEL PROTÓN
Generalmente se le acredita a Ernest Rutherford el descubrimiento del protón. En el año 1918 Rutherford descubrió que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo muestran los signos de núcleos de hidrógeno. Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que por tanto el nitrógeno debía contener núcleos de hidrógeno. Por estas razones Rutherford sugirió que el núcleo de hidrógeno, del que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental.
Antes que Rutherford, en 1886, Eugene Goldstein (1850-1930) había observado rayos catódicos compuestos por iones cargados positivamente. El físico alemán E. Goldstein realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre de rayos canales.
Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva o protón, cuya carga es la misma que la del electrón pero positiva y su masa es 1837 veces mayor.
MODELO ATÓMICO DE ERNEST RUTHERFORD
En 1910, Ernest Rutherford (que estudio con Thompson), utilizo partículas alfa para demostrar la estructura de los átomos. Juntos con sus colegas Hans Geiger (1882-1945) y Ernest Marsden (1889-1970), efectuaron una serie de experimentos utilizando laminas muy delgadas de oro como blanco de partículas alfa provenientes de una fuente radiactiva. Ellos observaron que la mayoría de las partículas atravesaban la lamina sin desviarse, otras se desviaban y otras pocas rebotaban en la misma dirección. Rutherford propuso que las cargas positivas de los átomos estaban concentrados en un denso conglomerado central dentro del átomo que llamó núcleo.
DESCUBRIMIENTO DEL NEUTRÓN
Fue predicho teóricamente en 1920 por Ernest Rutherford, recibió el nombre de "neutrón" de William Draper Harkins en 1921 y fue después propuesto por Santiago Antúnez de Mayolo en 1924 y en 1932 fue descubierto y documentado por James Chadwick (1891-1974).
MODELO ATÓMICO DE NIELS BOHR
El modelo atómico de Bohr (1885-1962) es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados. Dado que la cuantización del momento es introducida en forma adecuada (ad hoc), el modelo puede considerarse transaccional en cuanto a que se ubica entre la mecánica clásica y la cuántica. Fue propuesto en 1913 por el físico danés Niels Bohr,2 para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein.
En 1916, Sommerfeld perfeccionó el modelo atómico de Bohr intentando paliar los dos principales defectos de este. Para eso introdujo dos modificaciones básicas: órbitas casi elípticas para los electrones y velocidades relativistas. En el modelo de Bohr los electrones solo giraban en órbitas circulares. La excentricidad de la órbita dio lugar a un nuevo número cuántico: el número cuántico azimutal, que determina la forma de los orbitales, se lo representa con la letra L y toma valores que van desde 0 hasta n-1. Las órbitas son:
L = 0 se denominarían posteriormente orbitales s o sharp
L = 1 se denominarían p o principal.
L = 2 se denominarían d o diffuse.
L = 3 se denominarían f o fundamental.
PRINCIPIO DE DUALIDAD ONDA PARTICULA
En 1924, el físico francés, Louis-Victor de Broglie (1892-1987), formuló una hipótesis en la que afirmaba que:
Toda la materia presenta características tanto ondulatorias como corpusculares comportándose de uno u otro modo dependiendo del experimento específico.
Para postular esta propiedad de la materia De Broglie se basó en la explicación del efecto fotoeléctrico, que poco antes había dado Albert Einstein sugiriendo la naturaleza cuántica de la luz. Para Einstein, la energía transportada por las ondas luminosas estaba cuantizada, distribuida en pequeños paquetes de energía o cuantos de luz, que más tarde serían denominados fotones, y cuya energía dependía de la frecuencia de la luz a través de la relación: E=hv, donde “v” es la frecuencia de la onda luminosa y “h” la constante de Planck. Albert Einstein proponía de esta forma, que en determinados procesos las ondas electromagnéticas que forman la luz se comportan como corpúsculos. De Broglie se preguntó que por qué no podría ser de manera inversa, es decir, que una partícula material (un corpúsculo) pudiese mostrar el mismo comportamiento que una onda.
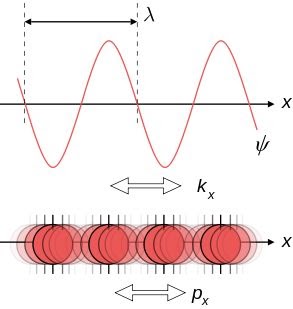
El físico francés relacionó la longitud de onda, λ (lambda) con el momento lineal de la partícula, mediante la fórmula, ( válida cuando v<
Dualidad Onda-Partícula
PRINCIPIO DE EXCLUSION DE PAULI (1900-1958)
Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero (fermiones). No se aplica a partículas de espín entero (bosones).
PRINCIPIO DE INCERTIDUMBRE
En mecánica cuántica, la relación de indeterminación de Heisenberg o principio de incertidumbre establece la imposibilidad de que determinados pares de magnitudes físicas observables y complementarias sean conocidas con precisión arbitraria. Sucintamente, afirma que no se puede determinar, en términos de la física cuántica, simultáneamente y con precisión arbitraria, ciertos pares de variables físicas, como son, la posición y el momento lineal (cantidad de movimiento) de un objeto dado. En otras palabras, cuanta mayor certeza se busca en determinar la posición de una partícula, menos se conoce su momento lineal y, por tanto, su masa y velocidad. Este principio fue enunciado por el físico teórico alemán Werner Heisenberg (1901-1976) en 1927.



























No hay comentarios:
Publicar un comentario
Envíanos tu opinión